UNIDAD V
PROTEÍNAS
 |
| https://www.asturnatura.com/articulos/nutricion/energia-nutrientes-componentes-dieta/proteinas-estructura-quimica.php |
- AMINOACIDOS ESENCIALES: Son aquellos que no pueden ser sintetizados en absoluto o a una velocidad suficiente para satisafcer sus necesidades, por lo que deben ser ingeridos en cantidades adecuadas por medio de la dieta.
- AMINOSACIDOS CONDICIONALMENTE ESENCIALES: Se denominan a sí por que tienden a agotarse durante la infancia o en condiciones de salud como estár enfermo, lo que significa que son esenciales bajo ciertas condiciones.
- AMINOACIDOS NO ESENCIALES: Son aquellos que se sintetian facilmente por las células de nuestro organismo.
CLASIFICACIÓN DE LAS PROTEINAS
SEGÚN COMPOSICIÓN QUÍMICA:
1. PROTEÍNAS SIMPLES ( holoproteidos): formadas solo por aminoácidos o sus derivados.
2. PROTEÍNAS CONJUGADAS ( heteroproteidos): formadas por aminoácidos acompañados de sustancias diversas y proteínas derivadas, sustancias formadas por desnaturalización y desdoblamiento de las anteriores.
2. PROTEÍNAS CONJUGADAS ( heteroproteidos): formadas por aminoácidos acompañados de sustancias diversas y proteínas derivadas, sustancias formadas por desnaturalización y desdoblamiento de las anteriores.
 |
| https://slideplayer.es/slide/17584119/ |
SEGÚN SOLUBILIDAD:
- Albúminas: Solubles en agua.
- Globulinas: Solubles en soluciones salinas diluídas.
- Glutelinas: Solubles en soluciones de ácidos y bases diluidos.
- Prolaminas: Solubles en soluciones acuosas de etanol.
- Neutros polares, polares o hidrófilos : Serina (Ser,S), Treonina (Thr,T), Cisteína (Cys,C), Asparagina (Asn,N), Glutamina (Gln,Q) y Tirosina (Tyr,Y).
- Neutros no polares, apolares o hidrófobos: Glicina (Gly,G), Alanina (Ala,A), Valina (Val,V), Leucina (Leu,L), Isoleucina (Ile,I), Metionina (Met,M), Prolina (Pro,P), Fenilalanina (Phe,F) y Triptófano (Trp,W).
- Con carga negativa, o ácidos: Ácido aspártico (Asp,D) y Ácido glutámico (Glu,E).
- Con carga positiva, o básicos: Lisina (Lys,K), Arginina (Arg,R) e Histidina (His,H).
- Aromáticos: Fenilalanina (Phe,F), Tirosina (Tyr,Y) y Triptofano (Trp,W) (ya incluidos en los grupos neutros polares y neutros no polares).
- Ciertas glucoproteinas forman parte de las membranas celulares y actuan como receptores o facilitan el transporte de sustancias.
- Las histonas, forman parte de los cromosomas que regulan la expresión de los genes
- El colágeno del tejido conjuntivo fibroso.
- La elastina del tejido conjuntivo elástico.
- La queratina de la epidermis.
- Las inmunoglogulinas actúan como anticuerpos frente a posibles antígenos.
- La trombina y el fibrinógeno contribuyen a la formación de coágulos sanguíneos para evitar hemorragias.
- Las mucinas tienen efecto germicida y protegen a las mucosas.
- Algunas toxinas bacterianas, como la del botulismo, o venenos de serpientes, son proteinas fabricadas con funciones defensivas.
PROTEINAS DE ALTO VALOR BIOLOGICO
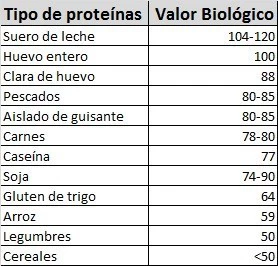 |
| https://www.vitonica.com/alimentos/el-valor-biologico-de-las-proteinas |
DIGESTIÓN
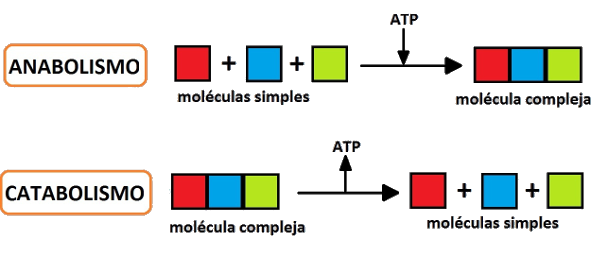
METABOLISMOLos términos metabolismo de las proteínas o metabolismo proteico hacen referencia a los diversos procesos bioquímicos responsables de la síntesis de proteínas y de aminoácidos, por medio del anabolismo proteico, y la degradación de proteínas (y otras grandes moléculas) por medio del catabolismo proteico.Las proteínas, al contrario que otras biomoléculas, no se almacenan. Todos los aminoácidos, ya sean de la dieta, se degradan. Los aminoácidos se metabolizan mediante la escisión, por un lado de su esqueleto carbonado y por otro lado del grupo amino, este último se eliminará en forma de urea. La digestión de las proteínas comienza en el estómago, donde serán atacadas por la enzima pepsina, y se completa en el duodeno y yeyuno. El jugo pancreático, junto con las enzimas que contienen las células intestinales, transformarán el contenido proteico en estructuras más simples. Estas pasarán a través de la mucosa intestinal hasta llegar a los enterocitos donde se completará la hidrólisis, obteniendo así aminoácidos y, en una menor cantidad, oligopéptidos. Estos aminoácidos, posteriormente son convertidos en α-cetoácidos los cuales pueden ser reciclados en el organismo para la producción de energía, glucosa o grasas o para la resíntesis de aminoácidos. Esta degradación de aminoácidos a α-cetoácidos se lleva a cabo en el hígado, por medio de un proceso conocido como transaminación. *CATABOLISMOConsiste en la transformación de las proteínas en aminoácidos y compuestos derivados simples para su transporte dentro de la célula a través de la membrana plasmática y, en última instancia, su polimerización en nuevas proteínas a través del uso de los ácidos ribonucleicos (ARN) y ribosomas. El catabolismo de proteínas, que consiste en la descomposición de macromoléculas, es principalmente un proceso digestivo.TRANSAMINACIÓN El grupo a-amino (nitrógeno) de los aminoácidos es separado del esqueleto de carbono, mediante el desarrollo coordinado de la transaminación y la desaminación oxidativa. Durante la transaminación, el grupo a-amino de los aminoácidos proteicos, excepto lisina, treonina y prolina, se transfiere a un cetoácido (esqueleto de carbono), en consecuencia se forma un nuevo aminoácido y se libera el cetoácido correspondiente al aminoácido inicial. Esta reacción es catalizada por las enzimas aminotransferasas, también llamadas transaminasas, muchas de las cuales utilizan a-cetoglutarato como cetoácido, por lo que tarde o temprano, el grupo amino de todos los aminoacidos es dirigido al glutamato.(Mvz & Nava, s/f) El amonio generado en la desaminación oxidativa es tóxico para las células, por lo que es convertido a urea en el hígado. Ya que todos los tejidos extrahepáticos producen amonio, es necesario un sistema de transporte adecuado. La mayoría utiliza a la enzima glutamina sintetasa para convertir el amonio en glutamina, producto atóxico. La glutamina se trasporta por la sangre al hígado, en donde la glutaminasa la hidroliza y se libera el amonio.(Mvz & Nava, s/f) *En este proceso del aminoácido quito al amino = me queda un cetoácido formando amoniaco ( NH3). SINTESÍS DE UREA El hígado es el encargado de realizar las funciones de transaminación, desaminación oxidativa y ciclo de la urea. A través de estos procesos metabólicos podemos utilizar las cadenas carbonatadas de los aminoácidos para producir energía, sintetizar lípidos o realizar la glucólisis (a través de una molécula de glucosa producimos energía en forma de ATP) y cetogénesis (catabolismo de ácidos grasos para formar cuerpos cetónicos utilizados en el ciclo de Krebs para producir energía). Durante la metabolización de los aminoácidos se produce NH3 (amoniaco) muy toxico para nuestro organismo que es transformado en Urea a través del ciclo de urea. La urea menos tóxica viaja hasta los riñones encargados de filtrar las sustancias toxicas de la sangre para finalmente convertirse en orina. GLUCOGENICOS: Se caracteriza porque se quita el grupo amino y esqueleto carbonado ayuda a formar: piruvsto, oxalacetato, fumarato, succinilco-A o a-cetoglutarato. CETOGÉNICOS: Se caracteriza al quitar amino, produce: Acetil-coA. https://es.khanacademy.org/science/biology/cellular-respiration-and-fermentation/pyruvate-oxidation-and-the-citric-acid-cycle/a/the-citric-acid-cycle *ANABOLISMOConsiste en la síntesis de moléculas orgánicas (biomoléculas) más complejas a partir de otras más sencillas, orgánicas o inorgánicas, con requerimiento de energía (reacciones endergónicas) y de poder reductor, al contrario que el catabolismo. Los procesos anabólicos son procesos metabólicos de construcción, en los que se obtienen moléculas grandes a partir de otras más pequeñas. En estos procesos se consume energía.*MOLECULAS GRANDES A OTRAS MÁS SENCILLAS. SINTESIS DE AA ( no esenciales) POR TRANSAMINACIÓN.
HOMEOSTASIS PROTÉICALa homeostasis proteica describe procesos dentro de las células que regulan la síntesis, el plegamiento y la degradación de proteínas en la célula para mantener la integridad del proteoma celular. La red de proteostasis incluye vías biológicas competidoras e integradas dentro de las células que controlan la biogénesis , el plegamiento, el tráfico y la degradación de las proteínas presentes dentro y fuera de la célula. La pérdida de proteostasis es fundamental para comprender la causa de las enfermedades asociadas con el plegamiento incorrecto y la degradación excesivos de proteínas que conducen a fenotipos de pérdida de función, así como a los trastornos degenerativos asociados con la agregación. *Tasa de recambio varia. *Proteína debe ser controloda por ( enzimas, hormonas) y descomposición. *Un individuo sano existe un balance entre síntesis y descomposición. REQUERMIENTOS NUTRICIONALESPara un adulto promedio, la recomendación es consumir al menos 0,83 g de proteína por cada kilogramo de peso corporal al día.EJEMPLOS: Un adulto de 70 kg debe aspirar a comer al menos 58 g de proteína todos los días. Esto equivale a la proteína que se encuentra en alrededor de 200 g de pechuga de pollo o 240 gramos de nueces mixtas.
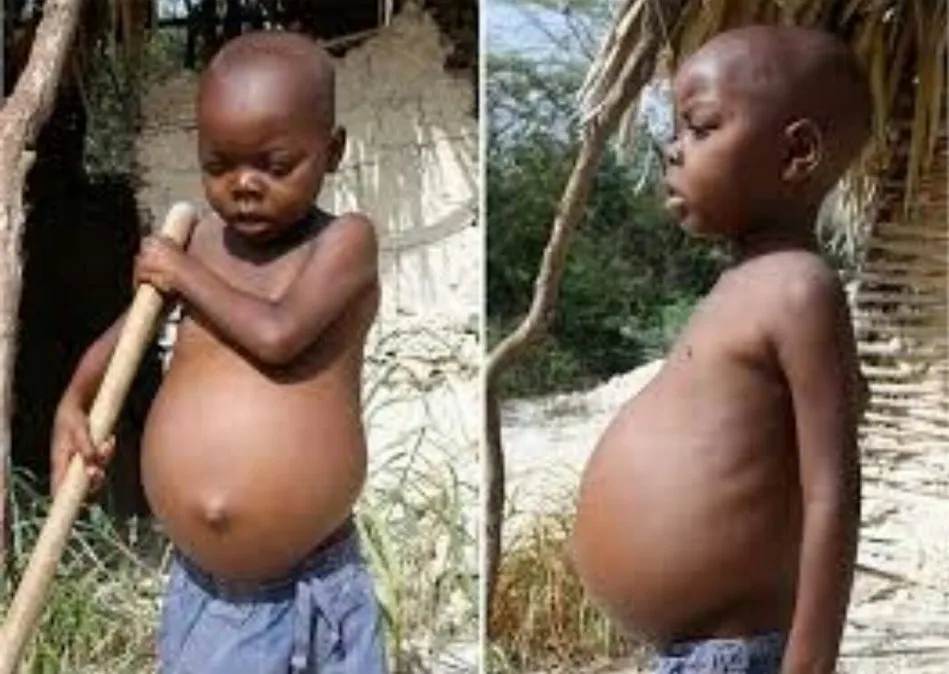
PATOLOGÍAS*SARCOPENIA: Es un trastorno que se caracteriza por la pérdida progresiva de la masa muscular y la función física que comúnmente se asocia con los adultos mayores. La sarcopenia se asocia con una mayor fragilidad, riesgo de caídas, deterioro funcional e incluso muerte prematura. Como la proteína es esencial para la reparación y el mantenimiento de la masa muscular, no sorprende que la baja ingesta de proteína se asocie con un mayor riesgo de desarrollar sarcopenia. *HOMOCITENURIA: Concentraciones bajas o ausencia de una enzima, puede originar aterosclerosis. *FENICETONURIA: Es la deficiencia o carencia de enzimas, genera acumulación de fenilalanina en sangre. *Kwashiorkor: Es una forma de desnutrición que ocurre cuando no hay suficiente proteína en la dieta. https://www.sanjuan8.com/a-un-click/sindrome-kwashiorkor-20102020_bi6iHqB_g ¿Qué consecuencias tiene el exceso de proteínas? •Obesidad: por aporte directo de energía, proporcionan 4 kcal/g porque van acompañadas de grasa saturada estructural. •Aumento de residuos indeseables: urea, ácido úrico. •Aumento de eliminación de calcio por el riñón. •Empeoramiento de algunas enfermedades: gota, insuficiencia renal, afecciones hepáticas,procesos reumáticos. •Disminución del peso del feto si sobrepasan el 20 % de las calorías totales de la dieta. (El Central de Zaragoza, s/f) La carencia de proteínas puede generar:
FUENTES¿ Diferencia entre proteinas de origen animal y vegetal?La calidad de una proteina se puede decifinir con distribución y proporción de aminoácidos esenciales y no esenciales. En general, las proteinas de origen animal son de mayor calidad ya ue contienen altas concentraciones de aminos esenciales en comparación con las proteinas vegetales. Con ellos existe la idea que las proteína vegetales carecen por completo de ciertos aminoacidos. Pero se ha comprobado que la mayoría contiene los 20 aminoácidos pero con la esepción que estarán en una cantidad limita, es poco probable que estos no suministren suficientes aminoácidos esenciales para cumplir con nuestro requerimiento. Por está razón se recomiendan las mezclas vegetales, que es incorporar cereales que aporten el contenido de los aminoacidos limitados como por ejemplo: el consumo de arroz (limitado en lisina y tiamina pero alto en metionina) y frijoles (limitado en metionina, pero alto en lisina y tiamina) proporcionará aminoácidos complementarios que pueden ayudar a cumplir con los requisitos esenciales de aminoácidos.
|

















Comentarios
Publicar un comentario